 Jeune chercheur de l’Institut de Chimie Moléculaire de l’uB, Benoît travaille en ce moment sur la synthèse d’un carbène N-hétérocyclique. Cela ne vous dit rien ?
Jeune chercheur de l’Institut de Chimie Moléculaire de l’uB, Benoît travaille en ce moment sur la synthèse d’un carbène N-hétérocyclique. Cela ne vous dit rien ?
Le café, messager de l’or
« Associée à l’or, la caféine permettrait de mieux supporter les traitements anti-cancereux », annonce Benoît Bertrand. Déjà 4 ans qu’il travaille sur la molécule.
Les thérapies combattent la prolifération des cellules cancéreuses. En utilisant des métaux nobles tels que l’or ou le platine, elles peuvent stopper leur multiplication. Parallèlement, la molécule de caféine peut agir comme un transporteur du métal puisqu’en modifiant légèrement sa structure, elle peut être transformée en un carbène.
Actuellement, le cisplatine – contenant du platine – règne parmi la médication de base. Mais les effets secondaires indésirables sont nombreux et éprouvants.
« Ces effets néfastes définissent les limites des doses administrables au patient (rapport bénéfice-risque). Plus, un patient supportera une thérapie, mieux il pourra être soigné », explique le chimiste dijonnais. Trouver une alternative demeure l’objectif principal de son étude. Son travail reste donc double :
- progresser dans la recherche thérapeutique
- améliorer les conditions des prises médicinales des patients.
L’or, biocompatible à l’organisme humain et la molécule de caféine présentent donc un grand intérêt pour l’expérimentation.
Premiers tests in vitro
Les travaux débutent en 2011, par la synthèse des molécules de caféine modifiées. Parmi les 7 molécules créées en ajoutant des fragments organiques, seule la plus proche moléculairement de la caféine et la plus soluble est retenue. Suivent des tests in vitro sur différentes lignées cellulaires (normales et malades) dans le but de vérifier que le composé s’attaque aux cellules cancéreuses. Cette analyse réalisée en partie à l’université de Groningen (Pays-Bas) confirme la mort de plusieurs lignées cellulaires malades sans pour autant affecter les saines.
La seconde étape consiste à mener de nouveaux essais ex vivo sur des tissus fraichement extraits d’animaux sains. Le laboratoire découvre alors que « le composé présente une faible toxicité sur les tissus sains de foie, du côlon ou du rein chez les rats. »
Un traitement dans 15 ans ?
Pour interpréter ces résultats, le doctorant fait équipe avec le docteur David Monchaud de l’Institut de Chimie Moléculaire de l’uB. Ce dernier travaille sur l’interaction entre de petites molécules et certaines structures de l’ADN. Ainsi, le même profil de sélectivité décelé sur les cellules cancéreuses est identifié sur ce squelette d’ADN. Cela signifie que le composant synthétisé aurait des propriétés pour agir sur la réplication de l’ADN des cellules malsaines.
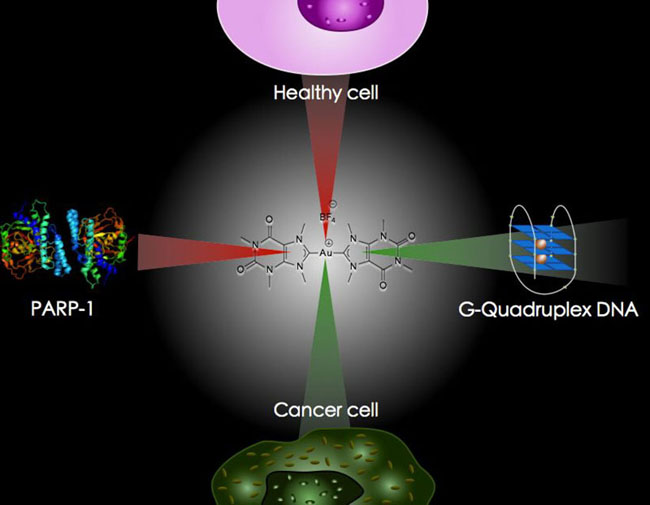
Prudent, le chercheur précise « pour le moment, l’étude en est à ce constat. Il faut maintenant prouver le mécanisme. Le composé doit entrer en phase clinique avec tests sur petit animal puis sur patient. La recherche est un processus long. Même si les résultats sont positifs, il faudrait tout de même attendre 15 ans avant d’en faire bénéficier les malades sous forme d’un traitement. » Trop tôt pour se prononcer, l’étudiant reste optimiste sur les avancés de ses travaux.
La réplication de l’ADN :
La réplication de l’ADN est le processus durant lequel l’ADN est synthétisé en une double molécule totalement identique. Cela permet de transmettre les informations génétiques contenues dans l’ADN (cellule mère) aux cellules filles se développant lors de la division cellulaire. C’est donc un processus très important qui concerne tout type de cellule. Certains traitements anti-cancéreux agissent à ce stade en abolissant la propagation de l’encodage des noyaux moléculaires « malades ».

